
▲高端新冠疫苗在通過緊急授權(EUA)前先量產遭疑,中央流行疫情指揮中心指揮官陳時中表示,預先量產如果EUA不通過,疫苗也不能上市。(圖/食藥署提供)
【NOW健康 陳敬哲/台北報導】今(2)日衛福部食藥署發布,完成4批高端新冠疫苗封緘檢驗,共265,528劑,外界質疑7月19日才核准高端緊急授權(EUA),僅半個月就能有疫苗完成檢驗,中央流行疫情指揮中心指揮官陳時中指出,預先生產已是國際慣例。
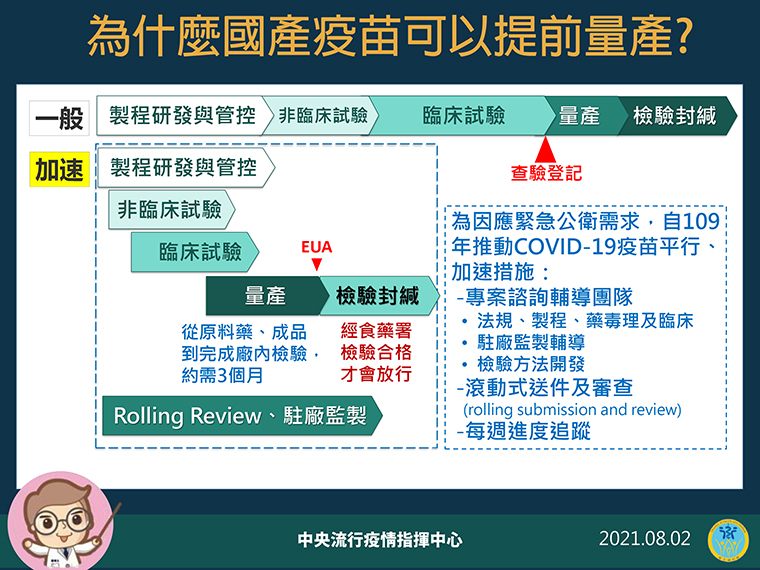
陳時中表示,各國在加快新冠疫苗研發生產,想辦法怎麼樣簡化流程,去年就針對國產疫苗有專案輔導團隊,在法定規範中讓行政流程更迅速,研發實驗過程中,採用高風險時間線重疊方式,如果先前實驗失敗接續實驗等於白做。
陳時中持續說明,美國給疫苗廠一大筆錢研發,如果有損失就算國家支出,台灣則用預採購方式,先付一定百分比定金,就當作投資生產與研發,要求廠商能加快速度,在審核EUA同時也開啟生產,假使UEA沒通過就當政府付材料費。
▲中央流行疫情指揮中心說明高端新冠疫苗提前量產過程。(圖/中央流行疫情指揮中心提供)
陳時中強調,如果採用先過UEA才生產疫苗,可能要拖3至4個月不等,失去緊急公共衛生效應,但也不因已經量產就非過EUA,仍然要經由專家檢驗,就算EUA通過,每批疫苗也都要經過食藥署檢驗封緘,才會開放民眾接種。
陳時中也說,一般藥品不會採用相同方式,仍然要走查驗登記取得核可,才能量產藥物,但新冠疫苗研製非常緊急,廠商冒著實驗失敗風險,政府設立獎勵金與預採購,先準備好開始量產,沒有通過EUA也不能上市。
更多NOW健康報導
▸疫情爆發緊張到快無法呼吸 改善預期性焦慮別不敢就醫
▸育兒津貼及托育補助新制加碼多少? 簡單1張圖報你知